Solicitudes de datos
Quién puede pedir datos
Los investigadores pertenecientes a grupos de investigación acreditados por el IDIAP o investigadores de atención primaria del ICS, podrán disfrutar de unas tarifas internas.
Los proyectos de investigación propuestos por grupos de investigación acreditados por IDIAP Jordi Gol serán de máxima prioridad por SIDIAP.
Los investigadores de grupos de investigación de otras instituciones públicas de investigación, también pueden solicitar datos al SIDIAP.
El marco normativo que regirá el acceso a los datos de SIDIAP por parte de estos grupos y/o instituciones se realizará mediante la firma de un convenio. Para establecer las condiciones de acceso a los datos se tendrán en cuenta varios aspectos (incluyendo la seguridad de los mismos).
El SIDIAP no cede datos a entidades con ánimo de lucro, pero sí puede llevar a cabo proyectos de investigación de calidad y entregar a su finalización los informes de resultados pertinentes, siempre y cuando estos proyectos provengan de un requerimiento de una Agencia Reguladora, como el European Medicine Agency (EMA) o la Food and Drug Administration (FDA).
También se aceptarán proyectos europeos que a pesar de estar financiados por entidades con ánimo de lucro, exista una participación pública y una convocatoria pública, como por ejemplo los proyectos del Innovative Medicines Initiative (IMI).
En una fase inicial se buscará un equipo de investigación del IDIAP, que será el encargado de definir el diseño del estudio junto con la entidad externa. Una vez cerrado el protocolo (y aprobado con los cambios necesarios por parte del CC SIDIAP y ético), el equipo investigador llevará a cabo el proyecto e irá entregando los diferentes informes acordados en el convenio previamente firmado entre el IDIAP Jordi Gol y el entidad externa. Estos estudios se ceñirán a las normas de conducta dictadas por ENCEPP.
Elementos clave de colaboración
- Uso de los datos exclusivamente para proyectos de investigación
- Los objetivos del proyecto no pueden ser contrarios a la política de salud del Instituto Catalán de la Salud
- Los comités de ética y órganos de gobierno deben haber aprobado los estudios antes de que éstos se inicien.
- No se transferirán datos no procesados al patrocinador del estudio. IDIAP se hace responsable del diseño del estudio y del análisis de datos. Se entrega un informe al final del estudio.
- Libertad de llevar a cabo estudios por otras entidades. Libertad de publicación. Independencia científica de acuerdo con el Código ENCEPP. Limitación de responsabilidades a la suma total de cada estudio.
- Derechos de propiedad intelectual. IDIAP mantendrá la propiedad intelectual o, en su defecto, se reserva el derecho a utilizar los resultados para su uso interno con finalidad de investigación no comercial o de docencia.
- Entrega de una copia de la Memoria en el Instituto Catalán de la Salud por uso interno.
Circuito de petición de datos
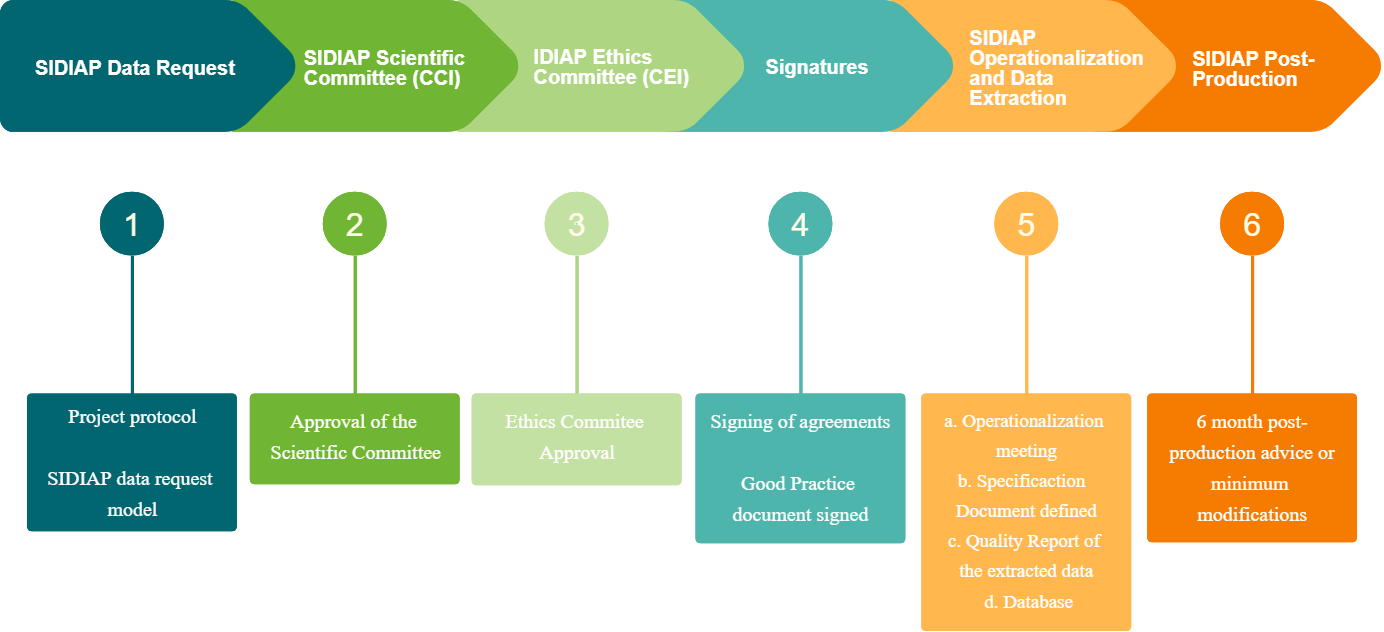
Solicitud SIDIAP
Es necesario enviar el Modelo de Solicitud por correo electrónico a Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo., y adjuntar el protocolo del estudio. Se recomienda consultar la guía de ayuda a Contenido de un Protocolo de Investigación. Para más información útil consulte el apartado Otros Recursos para el Investigador. El Comité Científico se reúne una vez al mes durante la primera semana y el plazo para recibir solicitudes es el día 15 del mes anterior.
Aprobación Comité Científico
El Comité Científico se reúne mensualmente el primer jueves de cada mes. Si la evaluación es Positiva: se enviará el protocolo al CEIC para su evaluación. Si se solicitan Aclaraciones: éstas se enviarán por correo electrónico al Investigador principal y/oa la persona que haya gestionado la solicitud. Habrá que volver a presentar el proyecto identificando las modificaciones realizadas con control de cambios y adjuntando una carta de respuesta a los revisores. El proyecto volverá a evaluarse en la siguiente reunión del Comité. El plazo para recibir las aclaraciones es 1 semana antes de la reunión. Si la evaluación fuese negativa: se notificarían los motivos de la denegación al Investigador Principal por correo electrónico.
Aprobación del Comité Ético
Todo proyecto realizado con SIDIAP necesita también la aprobación por parte del Comité ético. Una vez que el proyecto ha sido aprobado por el Comité Científico del SIDIAP, desde la Secretaría Técnica del SIDIAP lo enviaremos al CEI para su aprobación definitiva.
Firma de Convenios
Una vez aprobado el proyecto por el CC SIDIAP y por el CEI, se le notificará el Investigador Principal y se le enviará el Documento de Buenas Prácticas en el uso de datos SIDIAP, el cual nos deberá devolver firmado y escaneado.
Si el responsable del proyecto es de una entidad externa, es necesario firmar un convenio de colaboración con la entidad correspondiente. Tener estos dos documentos firmados es un requisito indispensable para seguir con las siguientes etapas
Producción / Extracción de Datos
Se concretará una reunión inicial con el IP del proyecto o equipo investigador y los técnicos de SIDIAP para resolver dudas y empezar la operativización del protocolo, es decir, transformar en protocolo epidemiológico a una serie de consultas bien parametrizadas tanto a nivel de variables como ventanas temporales, que pueda entender la base de datos.
Una vez hecha esta operativización se podrá realizar la extracción de la base de datos, que se le entregará al IP o al Data Manager del proyecto para su tratamiento.
Post-producción y Modificaciones de protocolo
Post-producción: El equipo investigador dispone de 6 meses para revisar y comprobar los datos. Las correcciones durante este período podrán tener cierta prioridad frente al resto de proyectos en los que se esté trabajando.
Pasado este tiempo, cualquier correción de datos y/o variables, deberá tener la aprobación del Comité Científico, quedando el proyecto a la cola de los proyectos en curso.
Modificaciones de protocolo: Si una vez iniciado el proyecto, hubiera que hacer cambios en el protocolo (cambios en la metodología, los objetivos, análisis, etc.) habrá que notificarlo al CC SIDIAP mediante el Modelo de Modificaciones y adjuntando, si es necesario, la nueva versión de protocolo, identificando los cambios realizados.
Cómo solicitar datos
Todos los protocolos presentados en SIDIAP deben contener los siguientes apartados:
- Título
- Investigador/a Principal (nombre, correo electrónico, institución)
- Resumen del estudio
- Palabras Clave
- Título y Resumen en Inglés
- Antecedentes, Justificación y Bibliografía
- Hipótesis
- Objetivos generales
- Objetivos específicos
- Metodología
- Diseño
- Ámbito y período de estudio
- Población de referencia
- Población de estudio con criterios de inclusión y exclusión
- Tamaño de la muestra y procedimiento de muestreo
- Variables (diferenciar entre dependientes e independientes)
- Recogida de datos y fuentes de información
- Análisis de datos
- Dificultades y limitaciones
- Consideraciones éticas y confidencialidad de datos
- Procedimientos adicionales derivados del estudio (explicar detalladamente los procedimientos que se realizan a los participantes del estudio, que no son de práctica asistencial habitual) (en su caso)
- Plan de trabajo (tareas, hitos y cronología)
- Experiencia del equipo investigador sobre el tema planteado
- Historial científico-técnico
- Aplicabilidad y utilidad práctica de los resultados del estudio
- Medios disponibles para la realización del proyecto
- Justificación de la financiación y presupuesto solicitado
- Posibles conflictos de interés
- Anexos (en su caso)
Con el fin de asegurar que los protocolos presentados para su evaluación contienen la información necesaria, se ha elaborado una guía de ayuda, "Contenido de un Protocolo de Investigación con SIDIAP", que incluye todos los aspectos considerados en las guías "STROBE" (estudios observacionales), RECORD (estudios observacionales con grandes bases de datos) y RECORD-PE (estudios farmacoepidemiológicos con grandes bases de datos). En el documento encontrará los enlaces a otras guías que ayudan a diseñar tipos de estudios más específicos.